細胞生物學試劑 NEST 為您帶來更全面的細胞培養(yǎng)解決方案,在原有的高品質細胞培養(yǎng)耗材產品線的基礎上,全面上線針對于培養(yǎng)基(DMEM高糖培養(yǎng)基、RPMI1640培養(yǎng)基、DMEM/F-12培養(yǎng)基、α-MEM 培養(yǎng)基、McCoy's 5A培養(yǎng)基、Leibovitz's L-15培養(yǎng)基)、活力檢測(細胞凋亡檢測試劑盒、細胞增殖檢測試劑盒)、細胞處理(抗生素/支原體清除劑、細胞消化解離試劑、細胞凍存試劑、平衡鹽溶液)三大方向所使用的試劑類產品,為高等院校、研究機構、醫(yī)院、CRO 及 CDMO 企業(yè)提供更全面的服務。 在細胞培養(yǎng)過程中,時刻觀察細胞凋亡狀態(tài)及細胞增殖情況有利于實驗員做實驗整體規(guī)劃。本文將介紹NEST細胞生物學試劑。
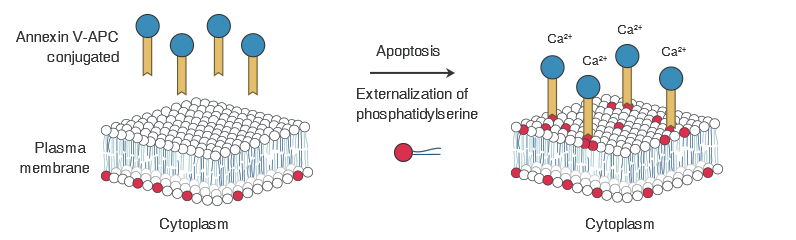
細胞凋亡(Apoptosis)是細胞程序性死亡(Programmed Cell Death,PCD)中特有的一種細胞死亡方式,在一系列內源性基因調控下發(fā)生,旨在維持內環(huán)境穩(wěn)定。
試劑盒檢測原理是什么?
NEST細胞凋亡檢測試劑盒采用細胞早期凋亡最常見的檢測方法——Annexin V-FITC/PI雙染法 (膜聯(lián)蛋白免疫檢測法)。
細胞發(fā)生凋亡時位于細胞膜內的磷脂酰絲氨酸(Phosphatidylserine, PS)會翻轉到細胞膜表面,暴露于細胞外環(huán)境中。
Annexin V是一種分子量為35.8KD的Ca2+依賴性磷脂結合蛋白,能夠與凋亡的細胞膜表面的PS發(fā)生高親和力特異結合。
利用特異結合特性,NEST細胞凋亡檢測試劑盒采用雙熒光染色法,以熒光素(如FITC、PE)標記的Annexin V作為熒光探針,核酸染料碘化丙啶(Propidium lodide,PI)作為第二個標記,利用流式細胞儀或熒光顯微鏡可以區(qū)分早期、晚期凋亡細胞以及死細胞。
優(yōu)勢
? 檢測早期凋亡最理想的方法之一,不需固定環(huán)節(jié)從而避免假陽性的產生。
? 只需15-20分鐘,簡便快捷。
? 嚴格可靠的質量控制,保證優(yōu)異的實驗結果
試劑盒操作步驟
1.樣品染色
1)將Binding Buffer(10×)稀釋成1×Binding buffer工作液備用(1mL Binding Buffer(10×) 需加入9mL無菌去離子水)。
2)收集細胞,加入預冷PBS溶液輕搖或用移液器輕柔吹打洗滌,離心收集細胞,共洗滌兩次。
3)在細胞沉淀中加入1×Binding buffer工作液,重懸細胞,使細胞濃度達到1×10^6 個/mL。
4)吸取100μL細胞懸液(細胞總數(shù)為1×10^5個)至一新管中,加入5μL Annexin V-FITC 和5-10μLPI,輕輕混勻,室溫避光孵育15min。
2. 樣品檢測
1)流式細胞儀檢測:
染色孵育后,每管加入400μL1×Binding Buffer工作液, 混勻后使用流式細胞儀檢測。
2)熒光顯微鏡檢測:
染色孵育后涂片,顯微鏡下觀察。使用熒光顯微鏡上的藍光和綠光通道分別觀察FITC和PI。被 Annexin V-FITC 結合的細胞顯示漿膜上有綠色光環(huán)。喪失細胞膜完整性的細胞細胞核顯示紅色,膜上有綠色光環(huán)。
注意事項
1)凋亡檢測實驗中細胞收集及處理是最重要的一環(huán),對于懸浮細胞,可采用500-1000g,離心5min收集細胞。
對于貼壁細胞,用不含EDTA的胰酶進行消化(注:對于比較難消化的細胞,也可以用含低濃度EDTA的胰酶消化,最后細胞多洗幾遍,減小EDTA鰲合鈣離子產生的影響),500-1000g離心5min收集細胞。貼壁細胞消化時間過長會造成細胞膜的損傷,導致Annexin V結果假陽性。最好是在輕輕吹打可以使貼壁細胞吹打下來時終止消化。
2)Annexin V-FITC 和碘化丙啶(PI)是光敏物質,在保存與操作時需避光。
3)可立式離心管內試劑在開蓋前需短暫離心,將蓋內壁上的液體甩至管底,避免開蓋時液體灑落。
4)PI具有細胞毒性,染色時間不宜過長。為獲得準確試驗結果,建議樣品在染色后1小時內進行分析。
5)在細胞洗滌的最后一步,請盡量將上清棄凈,以免 PBS 殘留影響實驗結果。
試劑盒訂購信息


細胞增殖是指細胞在周期調控的因子下,通過DNA復制等反應,完成細胞分裂的過程。增殖檢測一般是分析分裂中的細胞數(shù)量的變化,進而反應細胞的生長狀態(tài)及活性。
試劑盒檢測原理是什么?
NEST細胞凋亡檢測試劑盒采用CCK-8法。
NEST細胞凋亡檢測試劑盒內含有WST-8,是一種類似于MTT的化合物。在存在電子耦合試劑的情況下,WST-8可以被線粒體內的脫氫酶間接還原生成高度水溶性的橙黃色甲膜產物(formazan)。Formazan數(shù)量與活細胞的數(shù)量成正比。
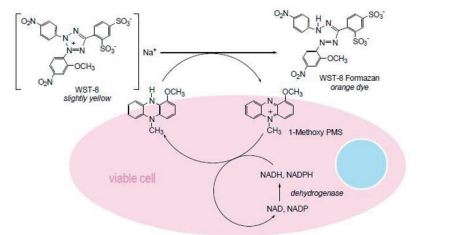
可利用這一特性直接進行細胞增殖和毒性分析,細胞增殖越多越快,則顏色越深;細胞毒性越大,則顏色越淺。使用酶標儀在450nm波長處測定OD值,可以間接反映活細胞的數(shù)量。
CCK-8法與傳統(tǒng)的測試方法相比,具有靈敏性高、反應時間短、線性范圍寬,數(shù)據可靠、重現(xiàn)性好等特點。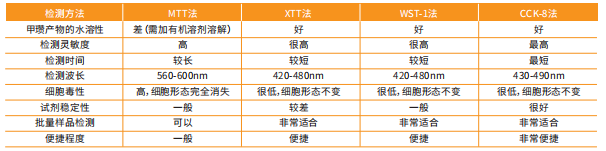
試劑盒操作步驟
1)制備細胞懸液:細胞計數(shù)。
2)接種到96孔板中:按比例(例如:1/2比例)依次用培養(yǎng)基等比稀釋成一個細胞濃度梯度,一般要做3-5個細胞濃度梯度,每組3-6個重復孔,每孔100μL細胞懸液。
3)37℃培養(yǎng)箱中培養(yǎng):細胞接種后貼壁大約需要培養(yǎng)24小時,如果不需要貼壁,這步可以省去。
根據實驗的實際需求進行后續(xù)不同操作
1.制作標準曲線(測定細胞具體數(shù)量時)
每孔加入10μLCCK-8增強型溶液,培養(yǎng)箱內孵育一定時間后測定450nm吸光度。
根據吸光度制作出一條以細胞數(shù)量為橫坐標(X軸), 吸光度為縱坐標(Y軸)的標準曲線。根據此標準曲線可以測定出未知樣品的細胞數(shù)量。
2.細胞活性檢測
每孔加入10μLCCK-8增強型溶液,培養(yǎng)箱內孵育0.5-4小時后在酶標儀下測定450nm吸光度。
3.細胞增殖-毒性檢測
在每孔加入0-10μL不同濃度的待測藥物后置于37℃培養(yǎng)箱中培養(yǎng)。根據待測藥物的性質和細胞的敏感性來設計細胞培養(yǎng)時間, 一般要根據細胞周期來決定,起碼要一代以上的時間。
如果待測藥物有氧化性或還原性的話,除去培養(yǎng)基,并用培養(yǎng)基洗滌細胞兩次,加入新的培養(yǎng)基后在每孔加入10μL CCK-8增強型溶液,培養(yǎng)箱內孵育0.5-4小時后在酶標儀下測定450nm吸光度,從而去除藥物影響。
藥物影響比較小的情況下,可以不更換培養(yǎng)基,直接扣除培養(yǎng)基中加入藥物后的空白吸收即可。
吸光度建議采用雙波長進行測定,檢測波長450-490nm,參比波長600- 650nm。
4.計算公式
細胞存活率 = [(As - Ab)/(Ac - Ab)] ×100%
抑制率 = [(Ac - As)/(Ac - Ab)] ×100%
As :實驗孔(含有細胞的培養(yǎng)基、CCK-8、待測藥物)的吸光度
Ac:對照孔(含有細胞的培養(yǎng)基、CCK-8、沒有待測藥物)的吸光度
Ab :空白孔(不含細胞和待測藥物的培養(yǎng)基、 CCK-8)的吸光度
注意事項
1)由于每孔加入CCK-8量比較少,有可能因試劑沾在孔壁帶來誤差,建議在加完試劑后輕輕敲擊培養(yǎng)板以幫助混勻,或者直接配制含10% CCK-8的培養(yǎng)基,以換液的形式加入。
2)因細胞種類不同,加入CCK-8增強型溶液后孵育形成的Formazan的量也不一樣,需要根據顯色情況調整孵育時長。對于大多數(shù)情況孵育1小時即可。如果顯色不夠的話,可以繼續(xù)培養(yǎng),以確認最佳條件。特別是血液細胞形成的Formazan很少,需要較長的顯色時間,如5-6 小時。
3)如果暫時不測定吸光度,為避免吸光度變化,可以向每孔中加入10μL0.1M HCl溶液或1%w/vSDS溶液,遮蓋培養(yǎng)板室溫下避光保存。最多維持24小時。
試劑盒訂購信息
